Ph больше 7 какая среда
Чистая вода нейтральна. Когда кислота растворена в воде, pH будет меньше 7 (25°C). Когда основание или щелочь растворяется в воде, pH будет больше 7….
Чистая вода нейтральна. Когда кислота растворена в воде, pH будет меньше 7 (25°C). Когда основание или щелочь растворяется в воде, pH будет больше 7. Раствор сильной кислоты, такой как соляная кислота, с концентрацией 1 моль дм имеет pH 0. Раствор сильного основания, такого как гидроксид натрия, с концентрацией 1 моль дм имеет pH 14. Таким образом, измеренные значения pH в основном находятся в диапазоне от 0 до 14, хотя вполне возможны отрицательные значения pH и значения выше 14. Поскольку pH является логарифмической шкалой, разница в одну единицу pH эквивалентна десятикратной разнице в концентрации водородных ионов.
Определение и измерение
Обратите внимание, что в этих уравнениях нет никаких приближений, за исключением того, что каждая константа стабильности определяется как отношение концентраций, а не активностей. Если необходимо использовать мероприятия, то требуются гораздо более сложные выражения.Пределы допустимых значений водородного показателя определены СанПиН 2.1.4.1074-01 «Питьевая вода». Согласно этому документу, значение pH питьевой воды не должно превышать 6-9.
Внешняя ссылка
Значение pH для обычной питьевой воды зависит от материала системы водоснабжения, состава исходной воды и температуры на улице. Однако он всегда остается между 6,5 и 9,5. Если значение pH сильно отличается, это означает, что где-то есть неисправность или в воде присутствуют инородные тела. Разница между двумя измеренными значениями pH пропорциональна значению pH. Этот метод калибровки позволяет избежать необходимости знать потенциал стандартного электрода. Константа пропорциональности, 1 / z, в идеале равна 1 2,303 R T / F { displaystyle { frac {1} {2,303RT / F}} \displaystyle slope».
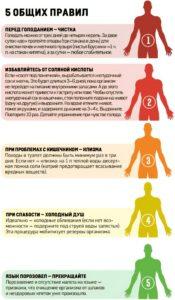
Почему ФТОР ОПАСЕН
Однако можно измерить концентрацию ионов водорода напрямую, если электрод откалиброван по концентрации ионов водорода. Один из обычно используемых методов заключается в титровании раствора сильной кислоты известной концентрации раствором сильного основания известной концентрации в присутствии относительно высокой фоновой концентрации электролита. Поскольку концентрации кислоты и основания известны, легко рассчитать концентрацию ионов водорода, чтобы можно было соотнести измеренный потенциал с концентрацией. Калибровка обычно выполняется с помощью графика Грана . Таким образом, эффект от использования этой процедуры заключается в приравнивании активности к численному значению концентрации.
Лакмусовая бумажка — самый дешевый и простой способ определения pH среды. Этот индикатор меняет цвет при реакции с водой, водородный показатель которой отличается от нейтрального. Бумага пропитывается красителями, которые вступают в реакцию с водой. В бумаге существует более полудюжины различных красителей. Большинство из них имеют естественное происхождение, то есть поступают из растений и лишайников.
ВОДА — одна из причин рака?
Не стоит забывать, что для других растворов и веществ кислотность может быть намного выше или ниже, чем у обычной воды. Например, лимонный сок имеет pH 2,5, кофе — pH 5, а мыло для рук — pH 10. Между тем, молоко, которое часто употребляют при изжоге в надежде снизить кислотность желудка, имеет почти нейтральный pH=6,6-6,9.Для щелочных растворов уравнение баланса массы водорода. Поскольку добавление гидроксида уменьшает концентрацию ионов водорода, а концентрация гидроксид-ионов ограничена равновесием самоионизации, равным K w [H +] { displaystyle { frac {K_ {w}} {{ ce {[H +]}}}}}
Читать подробнее
Некоторые системы, например, с полипротовыми кислотами, поддаются расчетам в электронных таблицах. В случае трех или более реагентов, или когда образуется несколько комплексов с общими схемами, такими как A pBqHr, для расчета pH раствора можно использовать следующий общий метод. Например, при трех реагентах каждое равновесие характеризуется константой равновесия β.Не нужно ходить в платные лаборатории, чтобы выяснить, какая вода с каким водородным показателем идет в чайник. Достаточно применить один из популярных индикаторов, и сразу станет ясно, нуждается ли вода в дополнительной обработке.
Магний и его роль в организме
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц, оформив подписку. При первом заказе наши новые клиенты получают в подарок 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с вами и расскажут подробности. Тел: 8 (800) 100-15-15
Решение этого квадратичного уравнения дает концентрацию водородных ионов и, следовательно, p [H] или, в более общем смысле, pH. Эта процедура проиллюстрирована в таблице ICE , которая также может быть использована для расчета pH, когда в систему добавляется немного дополнительной (сильной) кислоты или основания, то есть когда C A ≠ C H.
Лечение сезонной аллергии с помощью НАТУРАЛЬНЫХ РЕИНДУКТОРОВ
Индикаторы могут быть использованы для измерения pH, учитывая, что их цвет меняется с изменением pH. Визуально сравнивая цвет испытуемого раствора со стандартным цветовым графиком, можно измерить pH с точностью до целого числа. Более точные измерения возможны, если цвет измеряется спектрофотометрически с помощью колориметра или спектрофотометра. Универсальная индикаторная бумага состоит из смеси индикаторов, которые обеспечивают непрерывное изменение цвета от pH около 2 до pH 10. Универсальная индикаторная бумага изготавливается из абсорбирующей бумаги, пропитанной универсальным индикатором. Другой метод измерения pH — использование электронного pH-метра. Кроме того, тест-полоски можно сделать своими руками в домашних условиях. Для этого нужно отварить краснокочанную капусту в течение получаса, а затем замочить в остывшем растворе обычную бумагу для принтера примерно на десять минут. Если на полоску текста после высыхания капнуть кислотой, она покраснеет. Если бросить щелочь, она пожелтеет.
Светловская вода
Из pH + pOH = 14 видно, что pH может изменяться от небольших отрицательных значений до значений, немного превышающих 14 (pH NaOH с C = 2 равен 14,3). На рисунке 6.5 показан pH некоторых бытовых растворов и пищевых продуктов. При очень низких концентрациях необходимо также учитывать самоионизацию. Рассмотрим, например, раствор соляной кислоты с концентрацией 5 × 10М. В приведенной выше простой процедуре предполагается, что pH равен 7,3. Это очевидная ошибка, поскольку раствор кислоты должен иметь pH ниже 7. Если рассматривать систему как смесь соляной кислоты и амфотерной воды, мы получим pH 6,89.
ИНФОГРАФИЯ
Разница между двумя измеренными значениями ЭДС пропорциональна pH. Этот метод калибровки позволяет избежать необходимости знать потенциал стандартного электрода. Константа пропорциональности, 1 / z, в идеале равна 1 2,303 R T / F { displaystyle { frac {1} {2,303RT / F}} «Нернстианский уклон».
Точное значение p в pH оспаривается, поскольку Соренсен не объяснил, почему он его использовал. Он описывает метод измерения с помощью разности потенциалов, которая представляет собой отрицательную степень 10 в концентрации ионов водорода. Все слова, обозначающие его, начинаются на p во французском, немецком и датском языках, на всех языках, на которых публиковался Соренсен: Лаборатория Карлсберга была франкоязычной, в научных публикациях преобладал немецкий язык, а Соренсен был датчанином. Он использовал «q» аналогичным образом в другом месте статьи. Таким образом, «p» может означать французское puissance, немецкое potenz или датское potens, что означает «сила», или может означать «потенциал». Можно также произвольно обозначить тестовый раствор буквой «p», а стандартный — «q»; эти буквы часто используются в паре. Существует мало доказательств того, что «pH» является аббревиатурой латинских терминов pondus Hydrogenii (количество водорода) или Potentia Hydrogenii (сила водорода).
Внешние ссылки
Силиконовые кислоты и основания — это соединения, которые для практических целей полностью диссоциируют в воде. При нормальных условиях это означает, что концентрацию ионов водорода в кислотном растворе можно принять равной концентрации кислоты. В этом случае pH равен минус логарифму значения концентрации. Соляная кислота (HCl) является примером сильной кислоты. PH 0,01 М раствора HCl равен -log 10 (0,01), поэтому pH = 2. Гидроксид натрия, NaOH, является примером сильного основания. Значение p [OH] 0,01 М раствора NaOH равно -log 10 (0,01), т.е. p [OH] = 2. Из определения p [OH], данного выше, следует, что pH составляет около 12. Для растворов гидроксида натрия с более высокой концентрацией рассмотрим равновесие самоионизации. Имеется 3 нелинейных одновременных уравнения для трех неизвестных, [A], [B] и [H]. Поскольку уравнения нелинейны, а концентрации могут изменяться в диапазоне многих значений 10, решение этих уравнений не является простым. Однако существует множество компьютерных программ, которые можно использовать для выполнения этих расчетов. Реагентов может быть более трех. Расчет концентрации ионов водорода с использованием этого формализма является ключевым элементом при определении констант равновесия с помощью потенциометрического титрования.
Применение
Концентрацию ионов водорода можно измерить напрямую, если электрод откалиброван по концентрации ионов водорода. Один из обычно используемых методов заключается в титровании раствора сильной кислоты известной концентрации раствором сильного основания известной концентрации в присутствии относительно высокой фоновой концентрации электролита. Поскольку концентрации кислоты и основания известны, легко рассчитать концентрацию ионов водорода, чтобы можно было соотнести измеренный потенциал с концентрацией. Калибровка обычно выполняется с помощью графика Грана . Таким образом, эффект от использования этой процедуры заключается в приравнивании активности к числовому значению концентрации. pH-зависимые растительные пигменты, которые могут быть использованы в качестве индикаторов pH, содержатся во многих растениях, включая гибискус, красную капусту (антоцианин) и виноград (красное вино). Сок цитрусовых фруктов является кислым в основном потому, что содержит лимонную кислоту. Другие карбоновые кислоты встречаются во многих живых организмах. Например, молочная кислота образуется во время мышечной активности. Состояние протонирования фосфатных производных, таких как АТФ, зависит от pH. Действие кислородного фермента гемоглобина зависит от pH в процессе, известном как корневой эффект.
Видео
Если чистая вода подвергается воздействию воздуха, она становится слегка кислой. Это происходит потому, что вода поглощает углекислый газ из воздуха, который затем медленно преобразуется в бикарбонат и ионы водорода (по сути, образуя углекислоту).
Читайте далее: